Открытие российских биофизиков поможет найти лекарства от тысяч болезней
МОСКВА, 2 мар – РИА Новости. Ученые из России, Германии и Франции придумали методику, которая позволяет аккуратно кристаллизовать белки и изучать их структуру в "рабочей" форме, что поможет найти лекарства от тысяч болезней, связанных с "опечатками" в их структуре, говорится в статье, опубликованной в журнале ACS Crystal Growth & Design.
"Мы надеемся, что такой подход к кристаллизации, изученный в нашей работе на конкретном белке, можно будет обобщить на мембранные белки в целом. Комбинируя стабилизацию в нанодисках с современными методами кристаллизации и функциональными тестами, учёные по всему миру смогут лучше понять взаимосвязь структуры и функции молекул, необходимых для нормальной работы нашего организма", — поясняет Михаил Николаев из Московского физико-технического института в Долгопрудном.
Человеческая ДНК содержит в себе около 20 тысяч генов, несущих в себе инструкции по сборке молекул различных белков. Многие из этих белковых молекул обладают сложной трехмерной структурой, восстановить которую по последовательности "букв" ДНК ученые пока не могут. По этой причине их роль в жизни клеток и механизмы работы биологам приходится раскрывать, вылавливая одиночные молекулы белков, замораживая их и просвечивая при помощи мощных ускорителей энергии и рентгеновских лазеров.
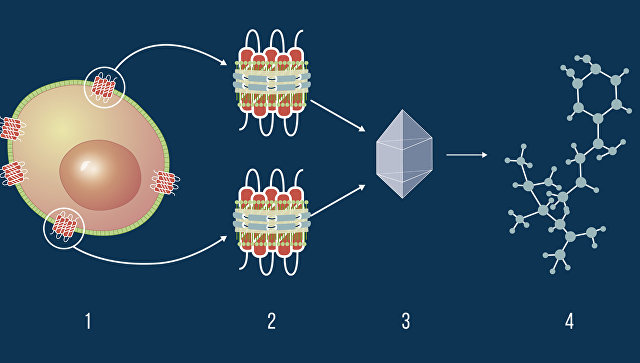
Проблема заключается в том, что многие жизненно важные белки, отвечающие за передачу сигналов между клетками и обмен веществ, встроены в мембраны клеток, откуда их крайне сложно извлечь, не повредив их структуры. По этой причине ученые сегодня применяют специальные нанодиски, имитирующие мембрану клетки, для сборки таких белков и изучения того, как они взаимодействуют с разными молекулами.
Такие наноструктуры, как рассказывает пресс-служба МФТИ, обычно бывают слишком большими для того, чтобы белок в них можно было рассмотреть при "рентгене". Поэтому биологи обычно прибегают к хитрости – они используют специальное "мыло" – молекулы-детергенты – для того, чтобы "выцепить" белок из искусственной мембраны непосредственно перед его заморозкой.
Как рассказывает Николаев, эта операция не всегда завершается без проблем для белка — иногда "мыло" стабилизирует белок в неправильной конфигурации, что мешает определению его реальной трехмерной роли и того, как структура белка влияет на его функции.
Ученые из МФТИ и западных научных центров создали новую остроумную методику изготовления таких дисков, благодаря которой они постепенно растворяются во время процесса кристаллизации. Кристаллы, выращенные таким образом, по качеству не уступают "мыльным" конкурентам, но при этом молекула белка остаётся в функциональном состоянии.
Работу этой методики ученые проверили, "заморозив" и изучив структуру хорошо изученного белка – бактериородопсина, светочувствительного пигмента, присутствующего в клеточных стенках некоторых микробов. Это вещество захватывает свет и использует его энергию для того, чтобы перекачивать протоны через мембрану микробов, извлекая из этого процесса энергию.
Качество фотографии, полученной таким способом, было аналогично тому, что удавалось достичь при помощи других методик "заморозки", что подтвердило работоспособность идеи российских ученых.
Как отмечают исследователи, на данный момент нам известны структуры всего 3% мембранных белков из 7 тысяч молекул такого рода, и создание новой методики их изучения, как надеются Николаев и его коллеги, поможет ускорить процесс их изучения и подбора лекарств для болезней, связанных с нарушением работы клеточных мембран.

